Niedawne odkrycie w badaniach nad komórkami macierzystymi jest niemałym wydarzeniem: badacze doszli do tego, jak przeprogramować dorosłą komórkę, by doprowadzić ją do stanu niemal nie do odróżnienia od zarodkowych, pluripotencjalnych komórek macierzystych. Jest to bardzo znacząca nowość, obiecująca przyspieszenie tempa badań w tej dziedzinie.
Problem zawsze polegał na tym, że komórki istnieją w odrębnych stanach. Na przykład komórka skóry ma uaktywniony jeden zestaw genów, niezbędny dla jej specyficznej funkcji, a inne zestawy genów są wyłączone. Zwykłe pobranie DNA z komórki skóry i wprowadzenie go do komórki jajowej niekoniecznie stworzy funkcjonalną komórkę jajową, ponieważ geny niezbędne dla komórki jajowej mogą być wyłączone w DNA komórki skóry, a nie wiemy jak je włączyć. Proces transferu jądra komórki somatycznej jest z tego powodu próbą robioną po omacku z bardzo wysokim procentem niepowodzeń — zasadniczo naukowcy próbują doprowadzić do właściwej konfiguracji włączonych genów dając jądru solidnego kopniaka i mając nadzieję, że coś w komórkach spowoduje rekonfigurację wzorca aktywacji genu w coś odpowiedniego.
Odkrycie Takahashiego i jego kolegów ujawniło jak wybiórczo włączać właściwy wzorzec genów na pluripotentne komórki macierzyste. Odkryli przycisk ponownego uruchamiania komórek ssaków, prosty włącznik, który wprowadza komórkę we właściwy stan, by mogła stać się dowolną komórką.
Ten przycisk ponownego uruchamiania składa się z czterech genów: Oct3/4, Sox2, Klf4 i c-Myc oraz specjalnego środowiska pozakomórkowego. Te geny są czynnikami transkrypcyjnymi, genami, które regulują ekspresję innych genów i podejrzewano, że są ważne, ponieważ — między innymi — są wyrażane w zróżnicowany sposób w normalnych zarodkowych komórkach macierzystych, czego byśmy nie wiedzieli, gdyby ludzie nie prowadzili badań nad zarodkowymi komórkami macierzystymi. Sądzi się, że geny c-Myc i Klf4 modyfikują chromatynę, zmieniając wzór metylacji DNA i modyfikacji histonowej, umożliwiając Oct3/4 i Sox2 wejście i związanie się z określonymi genami docelowymi. Te kilka genów, działając razem, wywołują cały szereg dalszych wydarzeń genetycznych, które przełączają komórkę w stan pluripotencjalny.
Rezultaty sprawdzano na kilka sposobów. Podobną procedurę zastosowano do myszy, by stworzyć całe zarodki mysie, które następnie rozwinęły się w dorosłe myszy, demonstrując w ten sposób totipotencję. Ludzkie indukowane pluripotencjalne komórki macierzyste poddano całej baterii prób i pokazują one ekspresję genów podobną do tej w prawdziwych zarodkowych komórkach macierzystych. Ponadto całe kolonie tych indukowanych komórek macierzystych wstrzyknięto myszom, gdzie tworzyły guzy — teratomy, nowotwory wielotkankowe, które różnicują się w szereg różnych typów tkanek (ale źle zorganizowanych — nie tworzą maleńkich ludzkich niemowląt wewnątrz myszy, a tylko porozrzucane kawałki). Tworzą się tkanki jelitowe, skóra, chrząstka i nerwy, jak widać na ilustracji poniżej, demonstrując pluripotencję tych komórek macierzystych.
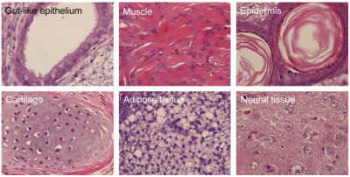
(kliknij, żeby uzyskać powiększenie zdjęcia)
Tkanki w górnym rzędzie od lewej: nabłonek jelitopodobny,
mięsień, skóra
Tkanki w dolnym rzędzie: chrząstka, tkanka tłuszczowa, tkanka nerwowa
Teratomy barwione hematoksyliną i eozyną pochodzące z komórek iPS (klon 201B7). Komórki przeszczepiono podskórnie w cztery różne części organizmu myszy SCID. Guz rozwinął się w jednym z tych miejsc.
Jest w tym pewien problem. Sposób aktywacji tych czterech genów jest skuteczny, ale brakuje mu nieco finezji: konstrukty zawierające geny z promotorami, które możemy kontrolować, zostały wprowadzone do komórek docelowych przez retrowirusową transfekcję. Z tą techniką są problemy. Geny są wprowadzane na miejsce losowo i mają możliwość tworzenia nowych mutacji. Ponadto nie są regulowane dokładnie w taki sam sposób jak normalne geny — co pozwala im na nieprzewidywalną ekspresję w komórkach. Na przykład, myszy, które powstały z indukowanych komórek macierzystych mają wysoką skłonność do chorób nowotworowych.
Badaczom udało się odkryć delikatny przycisk ponownego uruchamiania komórki, ale chwilowo do jego uruchomienia używają młotka.
Na początek to wystarcza i wykazali, że te cztery geny wykonują niezbędną pracę, ale z czasem chcielibyśmy znaleźć elegantszy sposób ich uaktywniania. Na przykład zamiast wstawiania dodatkowych kopii genów chcielibyśmy znaleźć sposób uruchamiania kaskad sygnałów, które zaktywizują naturalne kopie obecne w genomie; jakaś kombinacja czynników pozakomórkowych i wstrzykiwanie małych cząsteczek, które wykonują tę samą pracę co komórki w stanie ES (embryonic stem).
To odkrycie prawdopodobnie natychmiast stanie się obiektem politycznej gry, z politykami skrajnej prawicy, którzy ograniczyli amerykańskie badania nad komórkami macierzystymi, oznajmiającymi o potwierdzeniu się słuszności ich postawy. Podkreślmy jednak tutaj kilka spraw. Amerykanie nie dokonali tego odkrycie; zrobili to japońscy naukowcy. Wymagało to zrozumienia ekspresji genów w zarodkowych komórkach macierzystych, co w naszym kraju było utrudnione. Będzie wymagało znacznie więcej potwierdzeń i porównań między indukowanymi pluripotencjalnymi komórkami macierzystymi a zarodkowymi komórkami macierzystymi jako część procesu doprowadzenia tej techniki do użytku - nauka nie przyjmuje po prostu wyniku z kilku laboratoriów i nie akceptuje tego jako świętej prawdy. Oczywiście musimy wykombinować lepszy sposób włączania tych czterech genów. To wykombinowanie będzie wymagało dalszych badań nad tym jak organizmy przełączają komórki w stan ES in situ, a tego nie zrozumiemy na podstawie komórek z wstawionymi, sztucznymi konstruktami genowymi.
Innym istotnym punktem jest to, że naukowcy są podnieceni tą pracą, ponieważ otwiera ona drogę do badań podstawowych nad rozwojem i zróżnicowaniem. Te komórki NIE nadają się do terapii… do natychmiastowego, praktycznego zastosowania, jakie elektorat chce od badań nad komórkami macierzystymi. Nie można ich także użyć do klonowania reprodukcyjnego, chociaż to nie zmartwi większości ludzi. Są to komórki zakażone retrowirusem, z potencjalnie nieznanymi mutacjami i mają modyfikacje genetyczne, które powodują, że mają skłonność do rozwijania nowotworów. Nie będziemy w stanie tą techniką hodować nowych narządów i tkanek dla ludzi z kilku komórek ich skóry. Potrzeba dalszej pracy nad zarodkowymi komórkami macierzystymi, aby zrozumieć, jak wziąć dowolną komórkę z twojego ciała i czysto, elegancko przywrócić ją do stanu komórki macierzystej, którą da się ukształtować w każdy narząd, jakiego potrzebujesz. Ta praca pokazuje, że będziemy w stanie to zrobić, że nie będzie to trudne i że powinniśmy popierać badania nad komórkami macierzystymi już teraz, byśmy mogli wypracować te szczegóły.
Albo też możemy siedzieć bezczynnie i pozwolić Japończykom i Koreańczykom zrobić to za nas, co, jak sądzę, jest zupełnie w porządku. Pamiętajmy tylko, że oddanie badań innym oznacza, że uzyskują oni przewagę także w dokonywaniu wszystkich kolejnych przełomów i że świadomie umieszczamy naukę w USA w jednej z najbardziej obiecujących dziedzin badań biomedycznych na dalszym miejscu, nadając jej drugorzędny status.
Bibliografia:
Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanak S (2007), Induktion of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. „Cel" 131(4):1-12.
Tekst pierwotnie opublikowany był w blogu „Phartyngula", publikacja polskiego tłumaczenia w Racjonaliście za zgodą Autora.
PZ Myers Ur 1957. Amerykański profesor biologii na uniwersytecie w Minnesocie, prowadzi również popularyzujący naukę blog
Pharyngula. Ur 1957. Amerykański profesor biologii na uniwersytecie w Minnesocie, prowadzi również popularyzujący naukę blog
Pharyngula.Liczba tekstów na portalu: 109 Pokaż inne teksty autora |
Oryginał.. (http://www.racjonalista.pl/kk.php/s,5637)
(Ostatnia zmiana: 02-12-2007)